
Classification
Articles
 2023-08-21
2023-08-21  2023-07-28
2023-07-28 实验常用人肝癌细胞株(HepG2/Hep3B,HuH-7,MHCC97H,PLC/PRF/5)怎么选?
 2023-07-03
2023-07-03  2023-06-29
2023-06-29  2023-05-31
2023-05-31  更新时间:2017-07-07
更新时间:2017-07-07  浏览次数:1316
浏览次数:1316Chromatin Immunoprecipitation(ChIP)实验技术总结
ChIP是一项比较流行的研究转录因子(transcriptionfactor,TF)与启动子(promoter)相互结合的实验技术。由于ChIP采用甲醛固定活细胞或者组织的方法,所以能比较真实的反映细胞内TF与Promoter的结合情况。当用甲醛处理时,相互靠近的蛋白与蛋白,蛋白与核酸(DNA或RNA)之间会产生共价键。细胞内,当TF与Promoter相互结合(生物意义上的结合)时,它们必然靠的比较近,或者契合在一起,这个时候用甲醛处理,能使它们之间产生共价键。
原理:活细胞状态下固定蛋白质/DNA复合物—超声或酶处理将其随机切断为一定长度范围内的染色质小片段—抗原抗体的特异性识别反应沉淀此复合体—特异性富集与目的蛋白结合的DNA片段—对目的片断进行纯化与检测—获得蛋白质与DNA相互作用的信息。
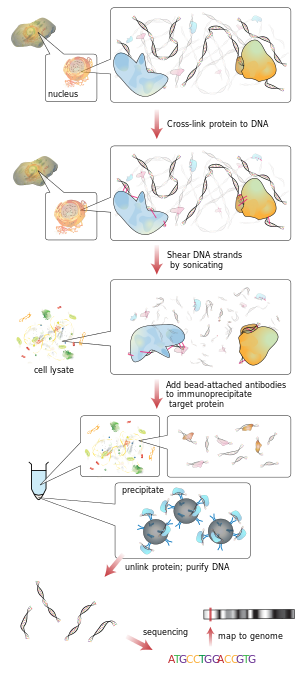
对于刚接触ChIP实验的同学,丁香园lorry_zgf师兄的实力技术总结肯定会让您豁然开朗!
一:细胞篇
细胞的生长状态要好。因为细胞的生长状态直接影响细胞内部的基因表达调控网络,也很有可能影响你所研究的TF与其靶Promoter的结合。一般细胞长到75%-80%比较好。
二:抗体篇
抗体是实验成败的致命因素之一!必须是IP级别的抗体。单抗与多抗的选择也需要仔细考虑。两种抗体各有利弊。单抗特异性强,背景低。但是单抗有一个致命的弱点,就是识别位点单一,而在ChIP甲醛交联的过程中,很有可能该位点被其它蛋白或核酸结合而被封闭,导致单抗不能识别靶蛋白。多抗虽然没有这个问题,但是多抗特异性较差,背景可能会偏高。一般而言,如果没有十足把握(单抗的识别位点远离靶蛋白与核酸结合的区域),选择多抗比较稳妥一些。
三:交联与超声破碎篇
交联的程度会影响到超声破碎的效果,交联的程度越高,超声破碎就越不易把基因组打碎成小片段。
交联不充分,只有一部分靶蛋白与其Promoter相结合,富集得到的Promoter的量不高,实验假阴性。交联过充分,基因组上结合了太多的蛋白,对超声破碎造成障碍。另外也会增加背景。一般来讲,按照我的经验,交联条件取决于细胞类型。不同的细胞系,交联的条件也不一样。例如:NIH-3T3的交联条件是室温(25摄氏度)下15min,1%的甲醛浓度,而别的细胞系则可能*不一样。而超声破碎的条件,机器不一样,条件也不一样。当然如果你有bioruptor这样的神器,那么超声破碎对你而言就是小菜一碟了。一般,理想的超声破碎得到的片段大小是200bp-1000bp。但是200bp-2000bp的范围也是可以接受的。
四:操作篇
尽可能的保持低温(4度)。沉淀的时候可以先在4度放置一会,等它自然沉降一些,再超低转速(500rpm等)离心使其*沉降。说明书上说ChIP实验的过程中有几个可以停顿的地方,能够连续做完,直到PCR结果出来为止。尽量避免实验中不可预知的影响因素。
五:解交联篇
说明书上说4小时已经足够,但建议解交联过夜。因为在那样的环境里,DNA不会降解,过夜解交联更充分些。只是不要忘记在EP管口封上封口膜。
六:DNA片段的回收篇
样品中SDS样品较高,普通的PCR产物回收试剂盒回收,很有可能会在zui终的样品中混入SDS,影响PCR实验结果。小Tip:过柱前,在样品中加入一定量的异丙醇,能有效的消除SDS沉淀。
电话